在生物制药行业中,蒸汽是关键的公用工程介质,广泛应用于灭菌、纯化、设备清洗(CIP)、工艺加热、洁净区加湿等环节。由于生物制药对洁净度、无菌性、可追溯性、合规性(GMP/FDA/EMA)要求极高,其蒸汽系统需满足高纯度、高可靠性、可验证性等特殊要求。
以下是一套面向生物制药行业的高纯蒸汽发生器应用方案,兼顾法规符合性与工程实用性。
一、应用场景与蒸汽类型
| 应用场景 | 所需蒸汽类型 | 关键要求 |
|---|---|---|
| 湿热灭菌(高压灭菌柜、SIP) | 纯蒸汽(Pure Steam) | 无化学添加剂、低内毒素(<0.25 EU/mL)、无挥发性杂质、符合USP <1231>、EP 2.2.44 |
| 洁净区加湿 | 洁净蒸汽(Clean Steam)或纯蒸汽 | 无油、无颗粒、低微生物、不污染环境 |
| CIP/SIP 系统加热 | 工业蒸汽或纯蒸汽(视接触物料与否) | 若接触产品或直接接触设备内表面,必须用纯蒸汽 |
| 工艺加热(夹套/盘管) | 工业蒸汽(间接加热) | 不接触产品,可使用洁净工业蒸汽 |
✅ 核心原则:凡与药品、药液、直接接触产品的设备表面接触的蒸汽,必须使用“纯蒸汽”。
二、纯蒸汽发生器系统方案
系统组:纯蒸汽发生器成
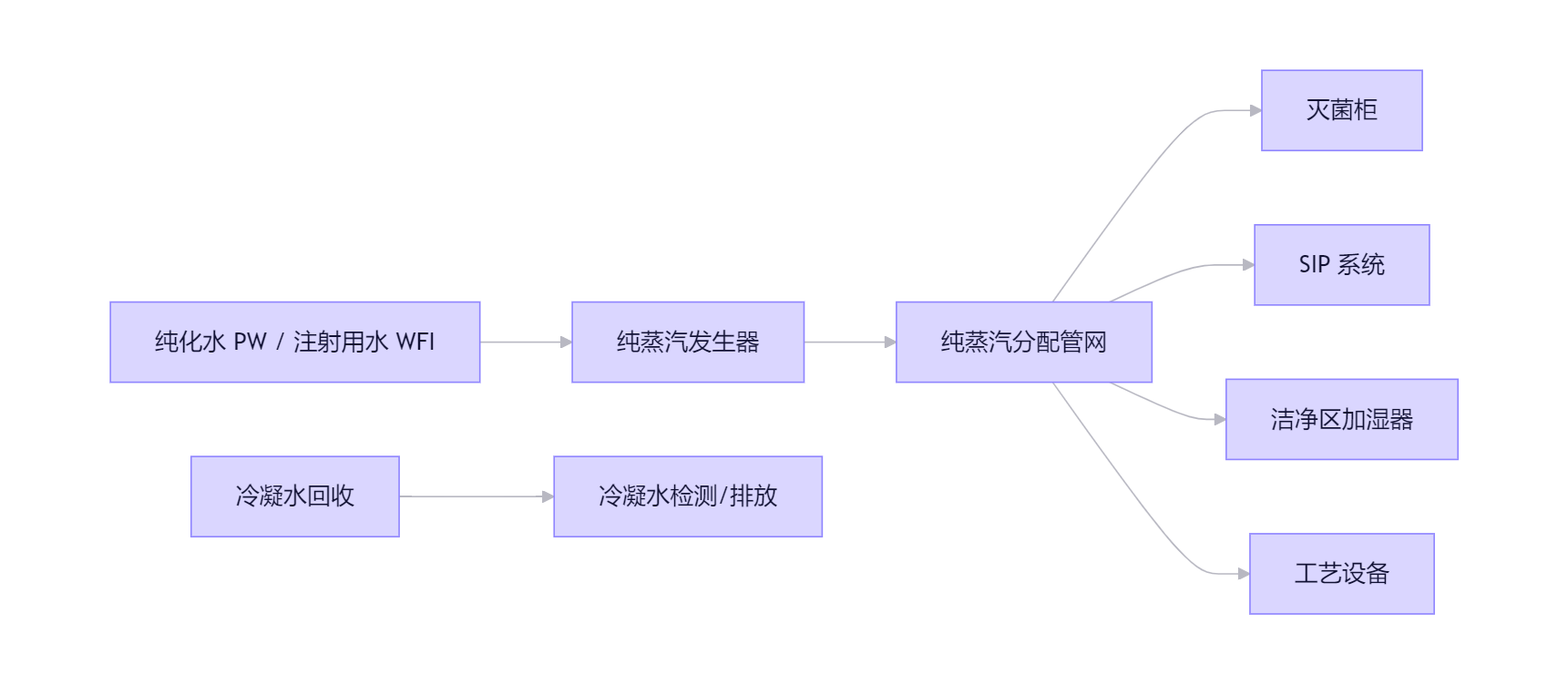
- 工作原理:以**注射用水(WFI)或高纯纯化水(PW)**为原料,通过电加热或洁净蒸汽(工业蒸汽)间接加热,产生不含任何添加剂的饱和纯蒸汽。
- 结构类型:
- 电加热式:适用于中小规模,无外来污染源,启动快。
- 洁净蒸汽换热式:利用洁净工业蒸汽作为热源,通过双管板换热器加热WFI,产汽量大,适合大型药厂。
3. 关键性能参数
| 参数 | 要求 |
|---|---|
| 原料水 | WFI(首选)或电导率 ≤1.3 μS/cm 的 PW |
| 蒸汽干度 | ≥95%(避免湿蒸汽影响灭菌效果) |
| 不凝性气体 | ≤3.5%(影响灭菌温度均匀性) |
| 内毒素 | <0.25 EU/mL(符合药典) |
| 微生物 | 不得检出(通常通过高温自灭菌设计保障) |
| 材质 | 接触部分为 316L 不锈钢,电解抛光 Ra ≤0.4 μm |
| 设计标准 | ASME BPE、GMP、FDA 21 CFR Part 211、EU GMP Annex 1 |

三、系统设计要点
1. 材质与表面处理
- 所有湿部件采用 316L 不锈钢,内表面电解抛光(EP),防止微生物滋生。
- 焊接采用自动轨道焊,100% 氩气保护,内窥镜检测。
2. 无死角与自排空设计
- 管道坡度 ≥1%,确保冷凝水完全排出。
- 避免“盲管”(L/D ≤2),采用卫生级隔膜阀、无菌取样阀。
3. 在线监测与验证支持
- 配置在线电导率仪、温度/压力传感器,实时监测蒸汽品质。
- 预留验证接口(如蒸汽取样点、冷凝水取样点),便于IQ/OQ/PQ验证。
- 支持数据记录与审计追踪(符合21 CFR Part 11)。
4. 冷凝水处理
- 纯蒸汽冷凝水可回收为WFI补充水(需检测合格)。
- 设置冷凝水内毒素与电导率在线检测,不合格自动排放。
四、典型应用配置示例
场景:无菌制剂车间 SIP 系统 + 高压灭菌柜
- 蒸汽需求:峰值 500 kg/h,持续 2 小时
- 方案配置:
- 纯蒸汽发生器:1 台 600 kg/h 电加热式,316L EP
- 原料水:WFI 储罐 → 多级离心泵 → 发生器
- 蒸汽分配:带保温的卫生级分配系统,带疏水阀组
- 控制系统:PLC + HMI,带报警、数据导出、电子签名
- 验证文件:提供FAT/SAT、DQ/IQ/OQ协议模板
五、合规性与验证
- 设计确认(DQ):确认设备符合URS(用户需求说明)及GMP要求。
- 安装确认(IQ):验证材质、焊接、仪表校准等。
- 运行确认(OQ):测试产汽能力、干度、不凝性气体、内毒素等。
- 性能确认(PQ):在实际负载下连续运行,证明系统稳定性。
提示:纯蒸汽系统必须纳入年度再验证计划,定期检测内毒素、电导率、微生物。
六、优势总结
| 传统工业蒸汽 | 生物制药纯蒸汽发生器 |
|---|---|
| 含化学处理剂(如胺、联氨) | 仅用水,无任何添加 |
| 内毒素/杂质风险高 | 符合药典纯度标准 |
| 无法用于直接灭菌 | 满足SIP/灭菌柜要求 |
| 难以通过GMP审计 | 全生命周期合规支持 |
七、选型建议
- 优先选择电加热纯蒸汽发生器(避免外来蒸汽污染风险)。
- 确保供应商具备制药行业经验,能提供完整验证支持文件。
- 系统设计需由具备GMP资质的工程公司完成,避免合规风险。


